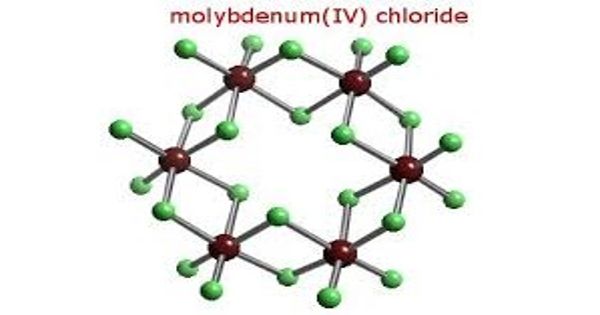
Le tétrachlorure de molybdène, ou chlorure de molybdène(IV), est un composé chimique de formule MoCl4. Il se présente sous la forme d'une poudre noire paramagnétique ou de cristaux prismatiques hexagonaux brun noir paramagnétiques, sensible à la lumière, à l'air et à l'humidité. Il est particulièrement sensible à l'hydrolyse et se dissout sans laisser de résidu dans l'eau, dans l'éthanol et dans l'éther diéthylique en donnant des solutions de couleur jaune à brun rouge. Il est volatil et se décompose partiellement en chlorure de molybdène(III) MoCl3 et chlorure de molybdène(V) MoCl5 lorsqu'il est chauffé au-dessus de 180 °C. Il présente une structure cristalline du système trigonal dans le groupe d'espace P31c (no 163) avec les paramètres a = 605,8 pm et c = 1 167,4 pm,. Cette forme α, constituée d'octaèdres MoCl6 formant des chaînes par leurs arêtes trans, se convertit à 250 °C en forme β constituée de cycles de six octaèdres MoCl6 unis par leurs arêtes cis. Dissous dans l'acide chlorhydrique concentré, il forme des sels complexes avec des chlorures alcalins, comme le pentachlorooxomolybdate de césium(V) Cs2[MoOCl5], de couleur vert pomme.
Synthèse et réactions
On peut obtenir du tétrachlorure de molybdène en faisant réagir du chlorure de molybdène(V) MoCl5 avec du benzène C6H6, du chlorure de molybdène(III) MoCl3 ou du perchloroéthylène Cl2C=CCl2 :
- 2 MoCl5 C6H6 ⟶ 2 MoCl4 C6H5Cl HCl ;
- MoCl5 MoCl3 ⟶ 2 MoCl4 ;
- 2 MoCl5 C2Cl4 ⟶ 2 MoCl4 C2Cl6.
Chauffé dans un récipient ouvert, il libère du chlore Cl2 en donnant du chlorure de molybdène(III) MoCl3 :
- 2 MoCl4 ⟶ 2 MoCl3 Cl2.
L'adduit complexe d'acétonitrile MoCl4(CH3CN)2 peut être obtenu par réduction du pentachlorure MoCl5 avec l'acétonitrile CH3CN, :
- 2 MoCl5 5 CH3CN ⟶ 2 MoCl4(CH3CN)2 ClCH2CN HCl.
Les ligands CH3CN du complexe peuvent être échangés avec d'autres :
- MoCl4(CH3CN)2 2 THF ⟶ MoCl4(THF)2 2 CH3CN.
Notes et références
- Portail de la chimie